셀트리온의 리툭산 (Rituxan, rituximab) 바이오시밀러인 트룩시마가 28일 (현지시간) 미국 FDA로부터 시판허가를 획득했다.
미국 리툭시맙 시장은 2017년 기준 41억 9800만 달러 규모로 리툭산의 전 세계 매출액의 55.9%에달하는 최대시장이다.
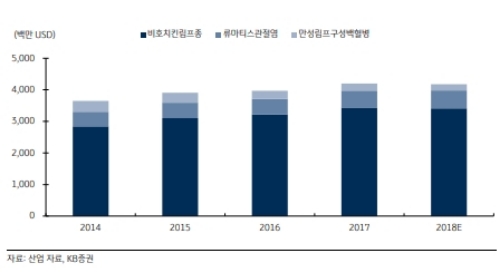
리툭산의 비호치킨림프종 관련 미국 매출액은 2017년 기준 34억 4,200만 달러 규모로 미국 전체 매출액의 82.0%를 차지하는 것으로 추정된다.
주요 경쟁사였던 산도즈 (Sandoz)가 미국 출시 포기를 선언함에 따라 초기 선점이 중요한 바이오시밀러시장에서 독보적인 위치 차지할 것이라는 분석이다. .
트룩시마는 이미 유럽시장에서 지난 2017년 4월 첫 출시 이후 폭발적으로 점유율을 확대해, 지난 2분기 기준 18개 출시 국가 내에서 32%에 달하는 점유율을 달성했다.
현재 가장 가까운 경쟁자로는 화이자 (Pfizer)의 PF-05280586으로. 지난 2018년 9월 FDA에 허가신청서를 접수하였으며, 예상 허가 시기는 2019년 3분기로 트룩시마와의 격차는 최소 7개월 이상으로 예상된다.
최성해 기자 bada@g-enews.com
[알림] 본 기사는 투자판단의 참고용이며, 이를 근거로 한 투자손실에 대한 책임은 없습니다.